体外—生物发光试验:
(1)材料:D-荧光素钾盐(美仑货号MB1834)、无菌纯水(美仑货号 MA0028)、完全培养基(自行配制)
(2)步骤:
① 用无菌水制备 100× D-荧光素钾储备液(15mg/ml),轻轻颠倒摇动至荧光素完全溶解,0.22μm滤膜过滤除菌。立即使用或分装后-20℃冻存。
② 将D-荧光素钾储备液溶解于预热好的组织培养基中,制备成浓度为 150μg/ml 的工作液。用组织培养基 1∶100 稀释储存液,配制工作液(终浓度150μg/ml )。
③ 去除培养细胞的培养基。
④ 图像分析前,向细胞培养板中添加 1×荧光素工作液,然后进行图像分析。
提示:成像前在 37℃下对细胞进行短时间孵育可增强信号。
体外—基因检测实验:
(1)材料:D-荧光素钾盐(美仑货号MB1834)、无菌纯水(美仑货号 MA0028)、25 mM tricine缓冲液 (pH 7.8) 、ATP、DTT、MgSO4、细胞裂解液
(2)步骤:
① 用无菌水制备100 mM D-荧光素钾储备液,立即使用,或分装后于-20℃下储存,避免反复冻融,避光。
② 在25 mM tricine缓冲液 (pH 7.8) 中制备含有3 mM ATP、1 mM DTT和15 mM MgSO4的1 mM D-荧光素钾工作液。
③ 将5-10 μL 细胞裂解物转移到孔板中。使用不含裂解物的裂解试剂或缓冲液作为空白对照。
④ 立即注入 200 μL D-荧光素钾工作液,结合时间为10秒。
体内—活体成像分析:
(1)材料:D-荧光素钾盐(美仑货号MB1834)、D-PBS(不含钙镁,美仑货号 MA0010)或PBS(美仑货号MA0015)
(2)配制溶液:
使用无菌 D-PBS(w/o Ca2+,Mg2+)或PBS配制 D-荧光素钾溶液(15mg/ml), 0.22µm 滤膜过滤除菌(避光),分装后于-20℃或-80℃冷冻保存,避免反复冻融。使用时 4℃融化,实验前平衡至室温(避光)。
(3)注射量取决于注射方式,具体如下:
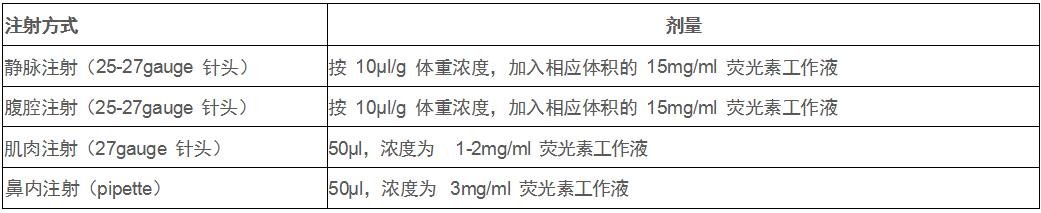
(4)注射入体内 10-20 min(待光信号达到最强稳定平台期),再进行成像分析。
注意: 建议对每只动物模型都建立荧光素酶动力学曲线,从而确定最高信号检测时间和信号平台期。保存和操作的过程中都要避光。另外水溶性储存液过滤除菌后,可以-20℃或-80℃分装冻存,避免反复冻融。
如果有条件,对储存液充氮气或氩气(防止氧化),稳定性和保存时间更长。注射方式、动物类型以及体重等都会影响信号的发射,因此建议每次实验都要做荧光素酶动力学曲线,确定最佳信号平台期和最佳的检测时间。
![]() and then Add to Home Screen.
and then Add to Home Screen.